اندازهگیری دقیق دوپامین با نانولولههای کربنی انجام شد
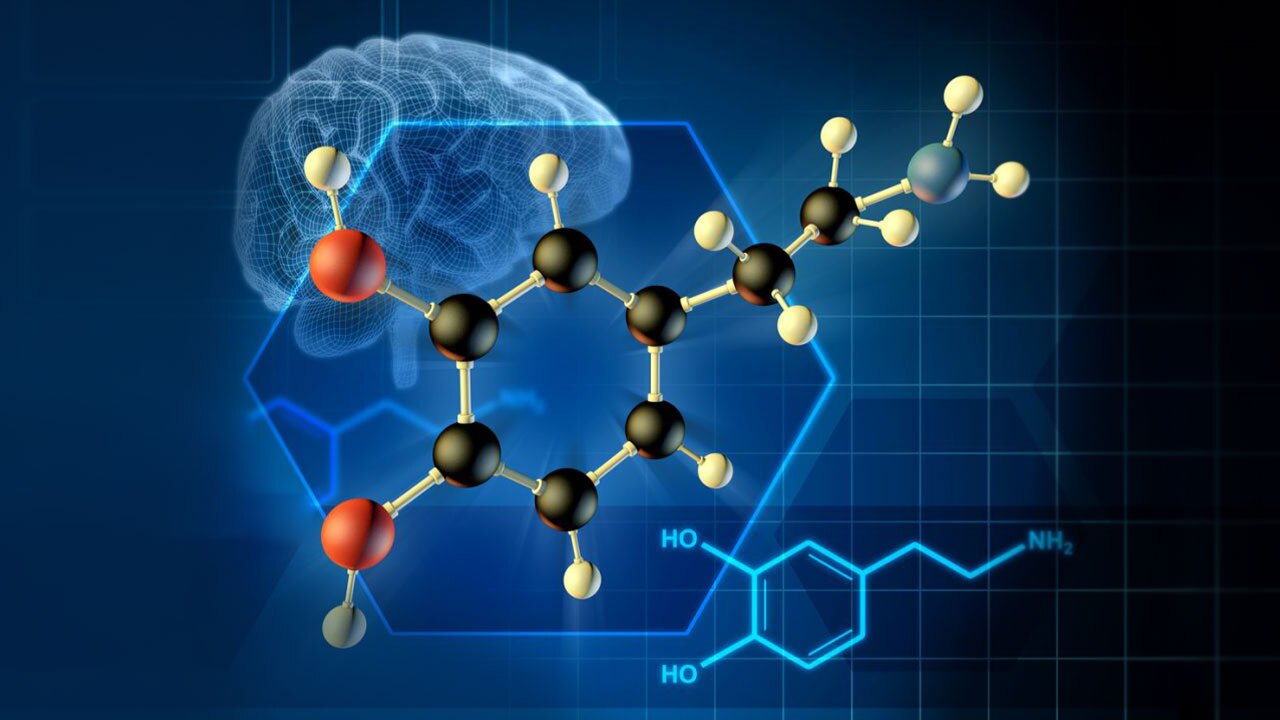
به گزارش گروه دانشگاه خبرگزاری دانشجو، دانشمندان روش جدیدی برای اندازهگیری دقیق دوپامین ابداع کردند. آنها از نانولولههای کربنی اصلاح شده برای رصد کمی و کیفی دوپامین در سلولها استفاده کردند.
دوپامین یکی از مواد شیمیایی پیام رسانی مهم در سلولهای عصبی است. تا به حال، تعیین غلظت آن با وضوح مکانی و زمانی بالا با چالشهایی روبرو بوده است. پژوهشگران نشان دادند که اندازهگیری آن با استفاده از نانولولههای کربنی اصلاح شده امکانپذیر است به طوری که این نانولولهها در حضور مولکول پیامرسان دوپامین درخشانتر میتابند. این روش توسط یک تیم تحقیقاتی از دانشگاههای روهر بوخوم، موسسه ماکس پلانک گوتینگن و دویسبورگ به کار گرفته شد. این حسگرها تصویری با وضوح بالا از ترشح دوپامین از سلولهای عصبی ارائه میدهند.
سباستین کروس از گروه شیمی فیزیک دانشگاه روهر بوخوم و جیمز دانیل و نیلز بروس از موسسه ماکس پلانک در این پروژه مشارکت داشتند.
دوپامین یک انتقالدهنده عصبی است که مرکز پاداش مغز را تنظیم میکند. اگر چنین انتقال سیگنالی از کار بیفتد، شرایطی مانند بیماری پارکینسون ایجاد میشود. علاوه بر این، موادی مانند کوکائین سیگنالهای مولکولی را در این بخش تغییر میدهند که این موضوع در مشکلات سوء مصرف مواد نقش دارد.
با این حال، تاکنون هیچ روشی وجود نداشت که بتواند سیگنالهای دوپامین را به طور همزمان با وضوح مکانی و زمانی بالا ترسیم کند.
سباستین کروس، سرپرست، گروه رابطهای عملکردی و بیوسیستم، دانشگاه روهر بوخوم میگوید: «اینجاست که حسگرهای پیشرفته به کار میآیند. آنها با لولههای کربنی بسیار نازک کار میکنند که ۱۰۰۰۰ برابر نازکتر از موی انسان است. وقتی در معرض نور مرئی قرار میگیرند آنها در طیف مادون قرمز نزدیک با طول موجهای ۱۰۰۰ نانومتر و بیشتر میدرخشند.»
سباستین کروس میافزاید: «این طیف نوری برای چشم انسان قابل مشاهده نیست، اما میتواند به عمق بافت نفوذ کند و در نتیجه تصاویر بهتر و واضحتری نسبت به نور مرئی ارائه دهد.»
علاوه بر این، در این محدوده، سیگنالهای پس زمینه به طور قابل توجه کمتری وجود دارد که ممکن است بر نتیجه تأثیر بگذارد.
سباستین کروس اظهار داشت: «ما به طور سیستماتیک این ویژگی را با اتصال توالیهای مختلف اسید نوکلئیک کوتاه به نانولولههای کربنی به گونهای اصلاح کردهایم که فلورسانس خود را در تماس با مولکولهای مشخص تغییر دهند».
تیم سباستین کروس نانولولههای کربنی را به نانوحسگرهای کوچک تبدیل کردند که به طور انتخابی به دوپامین متصل میشوند و بسته به میزان دوپامین موجود، کم و بیش درخشان میشوند.
او همچنین اظهار داشت: «ما بلافاصله متوجه شدیم که چنین حسگرهایی برای نوروبیولوژی جالب خواهند بود.»
در این پروژه برای اولین بار، محققان توانستند رویدادهای آزادسازی دوپامین را در سراسر ساختارهای عصبی ببینند و درک بهتری در مورد فرآیندهای آزادسازی دوپامین به دست آورند. این حسگرها بینش جدیدی در مورد انعطافپذیری و تنظیم سیگنالهای دوپامین ارائه میدهند. در دراز مدت، آنها همچنین میتوانند پیشرفت در درمان بیماریهایی مانند پارکینسون را تسهیل کنند.